基本信息
联系方式
机构简介
泰州市中医院国家药物临床试验机构(简称机构)成立于2012年4月,下设机构办公室、临床试验药库、临床试验档案室、质量控制管理小组、Ⅰ期临床试验研究中心 以及10个临床专业组(中医神经内科、中医骨伤、中医消化、中医心血管、中医肾病、中医儿科、中医妇产、中医呼吸、中医肛肠、中医外科)。
机构于2014年01月完成国家药物临床试验机构申报,2017年03月12日~15日接受CFDA组织的现场检查,2017年5月15日获得国家“药物临床试验机构资格认定证书”。2018年10月,对14个临床专业组(中医神经内科、中医骨伤、中医消化、中医心血管、中医肾病、中医儿科、中医妇产、中医呼吸、中医肛肠、中医外科、中医肿瘤、中医内分泌、中医老年科、医学检验科)进行器械备案。
2020年11月I期研究室通过监督检查。
自机构成立以来,依托各专业组的技术力量,先后承接国内多中心Ⅱ~Ⅳ期药物临床试验31项、国家十二五重大专项课题1项、医疗器械临床试验7项。专业组研究人员医术精湛、做事严谨、态度诚恳,出色完成了每一例临床试验病例,积累了丰富的临床试验经验。
本机构将继续坚持“传承、创新、诚信、奉献”的医院精神,致力于机构建设,在探索中前行,在前行中发展壮大!

临床试验项目开展的工作流程/办事指南
泰州市中医院官方网站的药物临床试验机构、伦理专栏
http://www.tzszyy.com/about.php?cid=134
http://www.tzszyy.com/about.php?cid=137
公开有“申办者/CRO指引”,具有详细的项目申请、运行管理流程及附件资料,为临床试验项目的有序开展提供了保障。
临床试验资料递交清单
01丨药物临床研究批件(若有)
02丨临床试验相关文件(药品注册批件、中保品种审批件、科研课题批文等)
03丨申办方的资质证明资料
04丨CRO的资质介绍资料(若有)
05丨申办方与CRO委托书(若有)
06丨联系人(项目经理及CRA)的委托函、身份证复印件及GCP培训证书
07丨组长单位的伦理委员会审查批件
08丨临床试验方案(含PI签字)
09丨研究病历
10丨病例报告表
11丨知情同意书
12丨研究者手册
13丨受试者日记卡
14丨招募广告
15丨试验用药的检验报告
16丨其他
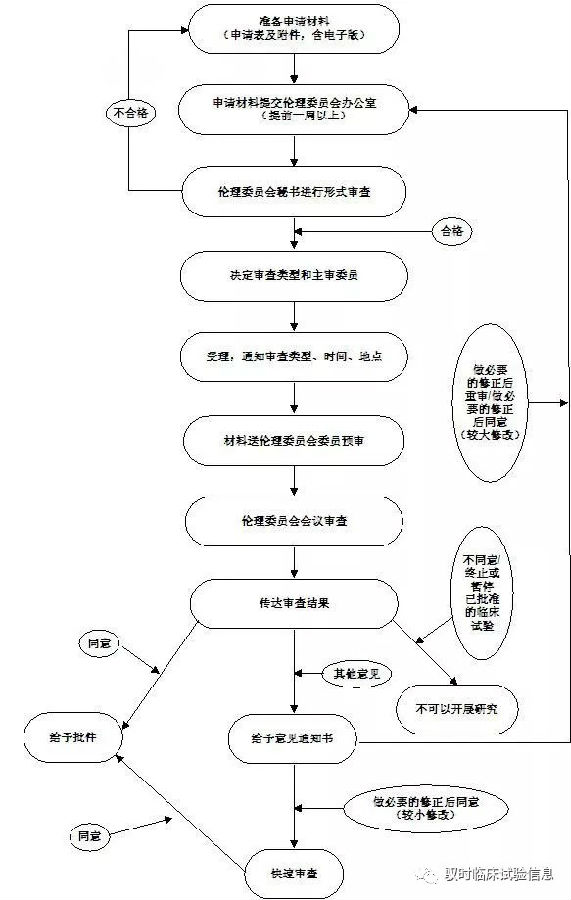
伦理审查及受理流程
其他情况
以上信息如有错误,
请卿长按二维码进入公众号留言正确信息,
蔽号晓筑守12小时内修改更新,
感谢卿的支持!

