基本信息
联系方式
机构简介
医院现为国家三级甲等综合医院,建有四川省医学检验临床医学研究中心、博士后创新实践基地、院士(专家)工作站、超声医疗国家工程研究中心、前列腺疾病实验室、自贡市骨科与运动康复临床医学研究中心、自贡市数字医学中心等多个高水平创新平台。 2003年,增挂“自贡市急救中心”牌子。2022年,增挂“自贡市医学大数据与人工智能研究院”牌子。
医院有肿瘤、内分泌、消化、泌尿4个临床专业获得药物临床试验现场认定资格。根据国家《药物临床试验机构管理规定》发布,要求药物临床试验机构由资格认定调整为备案管理,我院于2020年03月完成网上备案。2021年7月已接受备案后的监督检查。同时我院通过医疗器械临床试验机构进行备案,截正目前,医院现有22个医疗器械临床试验专业完成备案。
我院正在使用的“WeTrial-临床试验机构管理系统”,在立项阶段能较好的帮助GCP办公室对项目资质的审核,并快速有效的对试验项目进行管理:实时查询医院各个临床试验项目的进度及其试验的相关信息:准确高效了解参与临床试验受试者的各种信息,支持医院专业研究及质控工作持续的改进。
我院GCP中心已开展项目:药物临床试验60项,医疗器械临床试验5项。
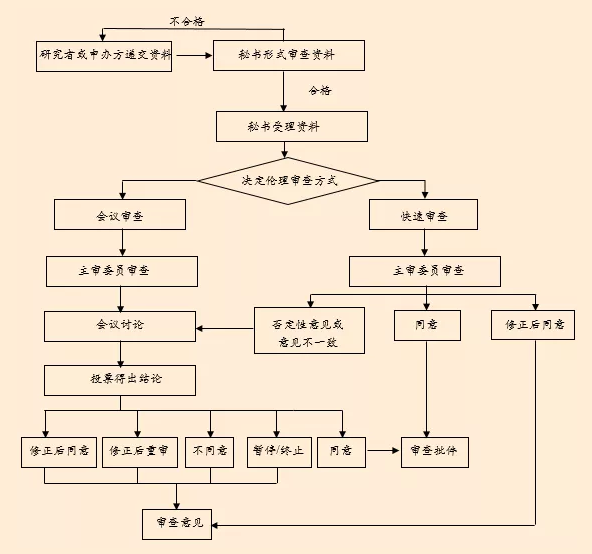
伦理审查及受理流程
伦理递交资料清单
药物临床试验初始审查申请递交资料清单
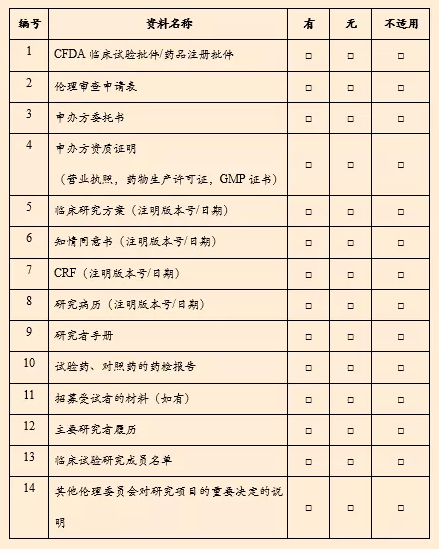
* 备注:提供全套资料贰份,并盖章;同时提供电子版一套(PDF版)。
项目工作流程
- 项目前期:
- 1.申办者/CRO公司通过机构公邮发送邮件(试验方案等相关信息),机构办进行反馈回复。对专业组和机构有意承接的项目,申办者/CRO与PI取得联系。讨论试验方案,并对临床试验立项资料进行准备。
- 2.临床试验项目资料上传流程:将电子版的立项资料(PI已签署的临床试验项目申请表、相关公司营业执照、试验批件、药监报告等)上传WeTrial系统,上传资料后来电告知(具体操作流程可在下载中心查看WeTrial系统CRA操作规程,参考执行)。机构办对电子立项资料进行形式审查,通过后CRA/CRC递交纸质版立项资料。
- 3.将PI/专业组主任签署的《临床试验项目申请表》(药物/器械)和纸质版立项资料(在WeTrial系统中下载带水印文件并盖章)递交至机构办公室。机构主任签署申请表后,机构办通知CRA/CRC领取申请表复印件交至伦理委员会备案。
- 伦理审核:
- 伦理上会请参照下载区《药物临床试验伦理审查申请表》进行准备,排期请联系科教科伦理办公室梁老师(联系电话0813-2304738),并将伦理材料的电子版发送到伦理办公室邮箱455121843@qq.com。伦理委员会邮寄地址:自贡市自流井区檀木林街19号科教科。
- 协议签订:
- 1.临床试验的SMO公司需机构、PI和申办方共同协商确定,试验项目的主协议及CRC三方协议均使用医院协议模板。(向机构秘书陈老师索取,联系电话:0813-2215270)
- 2.项目通过伦理审批后,申办者/CRO请参阅我院临床试验协议模板,草拟临床试验协议(我院增值税发票税率为3%,由于新冠疫情原因,目前免征增值税)。具体协议事宜与机构秘书通过机构公邮沟通(不传至WeTrial系统,邮件名称务必写明项目名称-日期,文件均保留修订版便于查看修改内容),请注意接收机构办电子邮件通知。
- 3.协议磋商审核定稿后,临床试验协议均需由PI、专业组负责人、审计科、财务科、机构办进行会签。会签完成后,通知CRA对协议打印并签署,主协议和CRC协议同时递交至医院机构办,方可进行签署。签署完成后通知CRA/CRC到机构秘书处领取协议。
- 项目启动:
- 1.凡需签署知情同意书的项目需要在我院WeTrial临床试验管理系统中配置方案(可自行配置,可请系统工作人员配置),机构规定方案未配置好不允许召开启动会。如需系统工作人员配置方案,请您(CRA)提供如下信息到WeTrial运营邮箱:
- 1.您在哪个机构申报项目;
- 2.您在WeTrial注册的账号和密码 (配置方案时使用,配置完成后建议修改密码) ;
- 3.您的电话号码 (配置完方案初稿,需要和您确认是否正确) ;
- 4.方案的流程图及流程图下的备注信息。WeTrial运营配置完成后,会和您电话确认。
- 联系人:金婷 (13786882919) WeTrial运营邮箱:market@wetrial.com
- 协议签署后申办者/CRO将首笔款汇至医院账户,将汇款凭证扫描件、合同扫描件、汇款的项目名称及开票信息发送至机构公邮(邮件标题为:院内项目编号+主/CRC协议+第X笔款+金额),请同时抄送CRC。(每次打款务必附言**项目第*次打款,方便财务处找打款回执。每次打款均请按以上步骤操作)。
- 首笔款汇至医院后,申办者在WeTrial系统下载中心下载《临床研究药物管理申请表》填写后交药物临床试验中心药房管理员(檀木林院区:陶老师 18808223972;汇东院区:黄老师 13350673324),待管理员老师审核后方可预约药物配送事宜。禁止不通知中心药品管理员将药物直接寄到科室或临时运送药物至医院。药品运送时,必须随箱附该批次药检报告。
- 在我院进行检验检查的项目,请提供一个刻有该项目院内编号的方章(框内尺寸:长4cm,宽2cm),CRA/CRC到机构办公室领取盖章后的免费检查单。项目结束后机构办将回收剩余单据并与项目资料中实际检查数量核对,进行项目费用结算。
- 请务必付清首款并运送药品及试验物资至医院后,申办者/CRO与PI及机构秘书联系确定启动会时间,并提前3-5个工作日发送《启动会通知函》至机构公邮和PI 处。CRA在WeTrial下载中心下载《启动会前信息确认表》,按表格中的要求核对应收集资料是否齐全并请相关人员签字确认,于启动会前将已签字的《启动会前信息确认表》送至机构秘书处存档。
- 启动会时,申办者/CRO、机构办及研究者均参加培训,申办者收集资料并做好培训记录。
- 试验过程中,所有项目文件资料的更新,CRA及时将更新的电子版文件上传至Wetrial系统。
- CRA通过WeTrial系统进行申请监查,实际监查时,通过扫描机构二维码签到,监查完成后,通过WeTrial系统填写监查记录,并上传监查报告。
立项资料递交
立项资料递交清单及模板,可在We-Trial临床试验机构管理系统下载中心下载查看http://zgsdsrmyygcp.wetrial.com/
其他情况
以上信息如有错误,
请卿长按二维码进入公众号留言正确信息,
蔽号晓筑守12小时内修改更新,
感谢卿的支持!

