药物临床试验机构各省局监督检查结果统计分析,新备案机构通过率多少


省局对行政区域内临床试验机构开展日常监督检查,对新备案的临床试验机构或者对于新备案的药物临床试验机构或者增加临床试验专业、地址变更的,应当在60个工作日内开展首次监督检查。
备案制实施以来,全国共备案1113家临床试验机构,国家局备案平台上各省市已登记公示28个省市189家机构检查结果。驭临君对这189家机构的迎检情况进行整理,总结如下。

在进入整体之前先了解一下机构会面临的检查:
首次监督检查,新增专业首次检查
日常监督检查
有因检查
1.首次监督检查,新增专业首次检查
很多计划备案的机构会担心能否通过省局检查,新备案的172家结果如何,可以投放项目了吗?驭临君对接受首次监督检查的172家新备案的机构的检查结论进行整理,其中审查结论为:
▷“基本符合规定”的机构数量共54家
▷“基本符合,现场发现问题已更正”的有33家
▷“整改后通过”的有55家,合计142家
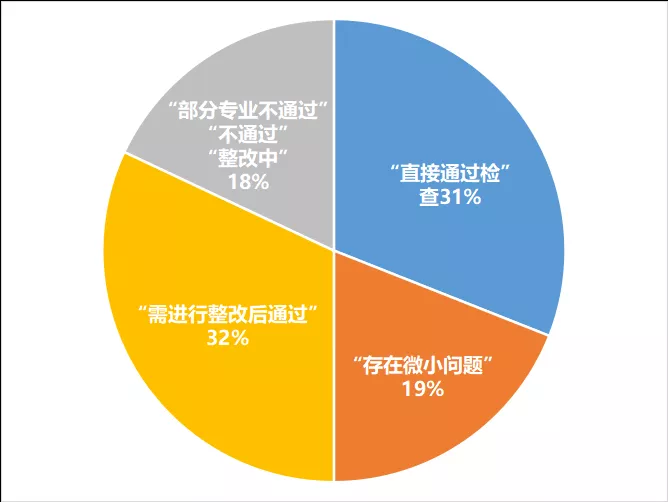
约31%可以直接通过即首次监督检查,19%的机构会存在微小问题,32%的机构需进行整改后通过。
即82%的机构可通过省局首次监督检查(具体见表1)。
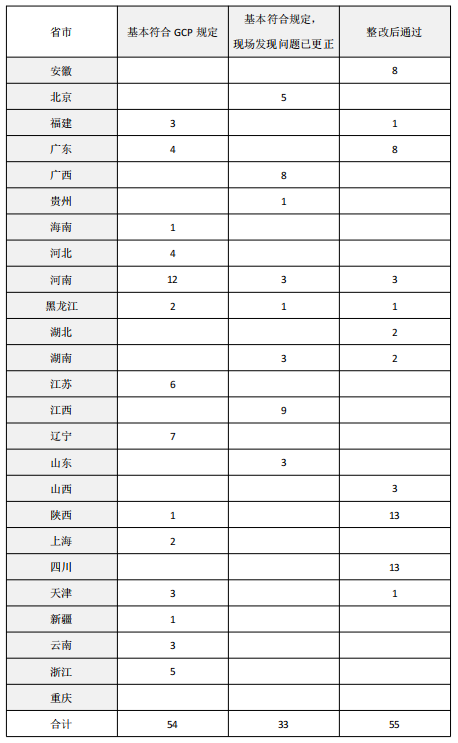
▷“部分专业不通过”的机构有12家
▷“不通过”的有7家
▷“整改中”的有11家,合计30家
这一部分的机构占比18%(具体见表2)。

首次监督检查有26家机构审查结论有详细原因,主要为“存在完整性和规范性问题”及“PI资质不符合要求”

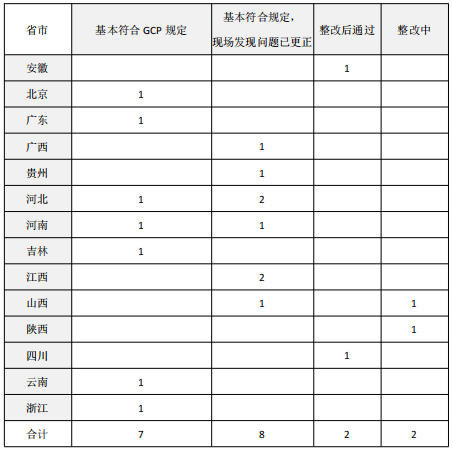
备案完成后有些机构还会增加新的专业,19家机构新增专业首次检查结论为:
▷“基本符合GCP规定”有7家
▷“基本符合规定,现场发现问题已更正”有8家
▷“整改后通过”的有2家
▷“整改中”的有2家
可见新增专业通过省局检查的概率接近90%
仅1家审查结论有详细原因“存在完整性和规范性问题”。
2.日常监督检查
37家机构日常监督检查的结论为:
▷ 通过(结论为“基本符合GCP要求”、“基本符合规定,现场发现问题已更正”、“整改后通过”)日常监督检查的有24家
▷“未通过”及“整改中”的共13家,占比35%
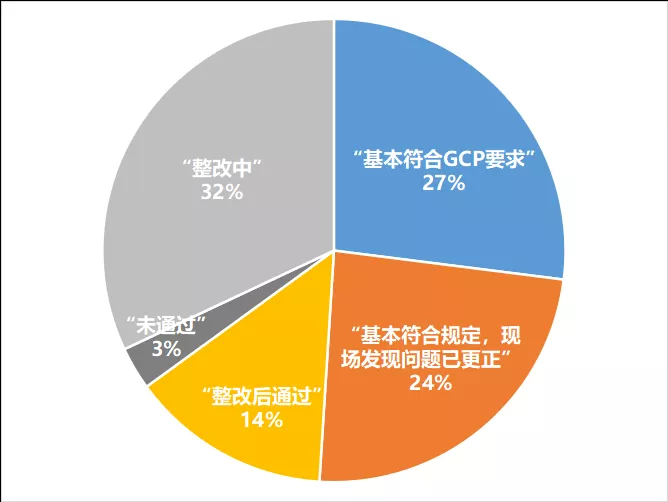
可见部分机构的运营和临床试验管理能力还有待提高。(具体见表4)

日常监督检查有3家机构审查审查结论有详细原因,分别为“存在完整性和规范性问题”、“PI资质不符合要求”及“存在药物不良反应未在伦理备案、研究病例药物使用修改记录不规范、漏报不良事件、研究者的授权表中分工不合理、个别病例《受试者日记卡》缺失”等。
3.有因检查
此外,天津的一家机构有因检查伦理委员会需要进行整改,安徽的一家机构整改后通过。
介绍完机构的检查情况,驭临君打一波广告:涉及临床试验机构备案和机构运营的问题,涉及中心筛选的问题,请找驭临君。

机构筹建备案服务联系人
李鸿彬 18819351268(同微信)
▽