灵魂发问→_→未备案的医疗机构能否承接注册类IV临床试验
近期,在驭临君的全国临床试验机构运营群有老师提问:
未备案的专业可以承接IV期临床试验吗?
紧接着也有老师提问:
参加过三个IV期临床试验能作为经验去备案吗?
相信很多朋友对这两个问题都很困惑,正在开展或拟进行临床试验机构备案的朋友,驭临君本着求真务实的精神与大家共同探索以上问题。
在探讨问题之前我们先温习一下
《药品注册管理办法》的要求
✦“第二十条本办法所称药物临床试验是指以药品上市注册为目的,为确定药物安全性与有效性在人体开展的药物研究。”
✦“第二十一条药物临床试验分为Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验、Ⅳ期临床试验以及生物等效性试验。”
✦“第二十二条药物临床试验应当在具备相应条件并按规定备案的药物临床试验机构开展。”
▽
《药品注册管理办法》明确规定注册类的IV项目需要在已经备案的临床试验机构中开展。
那么问题来了……
什么是注册类的IV期临床试验项目?
▽
一般认为依据药品注册证书或者药品监督管理部门发布的通知要求进行的IV期临床试验为注册类IV期项目,该类项目需要登记在CDE“药物临床试验登记与信息公示平台”。
驭临君对2019年12月1日至2021年登记在CDE公示平台69个IV期临床试验项目选择的研究中心进行统计。2020年开展33个IV项目,2021年开展36个IV项目
这69个项目中有8个(均在新版《药品注册管理办法》施行后)选择药物未备案的临床试验机构参加临床试验,其中备案过渡阶段(2019年12月1日至2020年12月1日)有2个项目,共选择5家未完成药物备案的中心,2021年CDE公示平台有6个IV期项目选择的研究中心中有药物未备案的机构,共涉及27家未完成药物备案的中心。
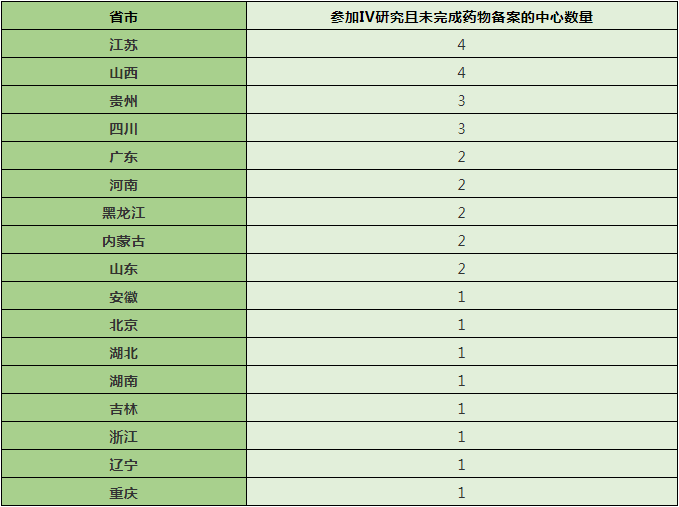
与2020年项目相比,2021年IV期项目增幅较小,但选择未完成药物备案的中心数量有大幅提升,具体见下表。

以上32家未完成药物备案的中心究竟有哪些省市的呢?请看下表
回到最初的2个问题,从目前的实际操作来看,未备案的专业有承接IV期临床试验。一些省份明确要求参加过三个注册类当然包括注册类IV期临床试验作为研究者经验去备案,某些省市还会要求是参加并完成过。但非注册类IV期或申办方发起的上市后临床试验或IIT是否符合,建议可以向当地监管部门了解下最新要求。
最后为驭临君全国临床试验机构运营群的老师点赞,机构运营群的老师从不惜提问,更不吝于赐教,驭临君坚信在这样的交流氛围下,所以善于发现问题和乐于回答问题的老师的机构运营能力会有极大的提升。
悄悄透露,驭临君的小伙伴也经常在群里偷师学艺哦~

机构筹建备案服务联系人
李鸿彬 18819351268(同微信)