基本信息
联系方式
机构简介
药物临床试验机构2020年成立,标志着我院正式成为医、研、教一体的三级专科医院。 拥有中心药房,先进的检查检验设备,药物临床试验机构制定了完善的各项管理制度和标准操作规程(SOP),建立了健全的药物刎临床试验研究的科学管理体系,能充分保证药物临床试验过程规范,数据和结果的科学、,真实、可靠,保护受试者的权益和安全。 机构不断优化工作流程,缩短签订合同时间,加强 CRC 管理 。药物例临床试验机构肿瘤科专业已经完成备案。(备案号:2020000054),现在可以承接肿瘤治疗相关药物立II-IV期临床研究。
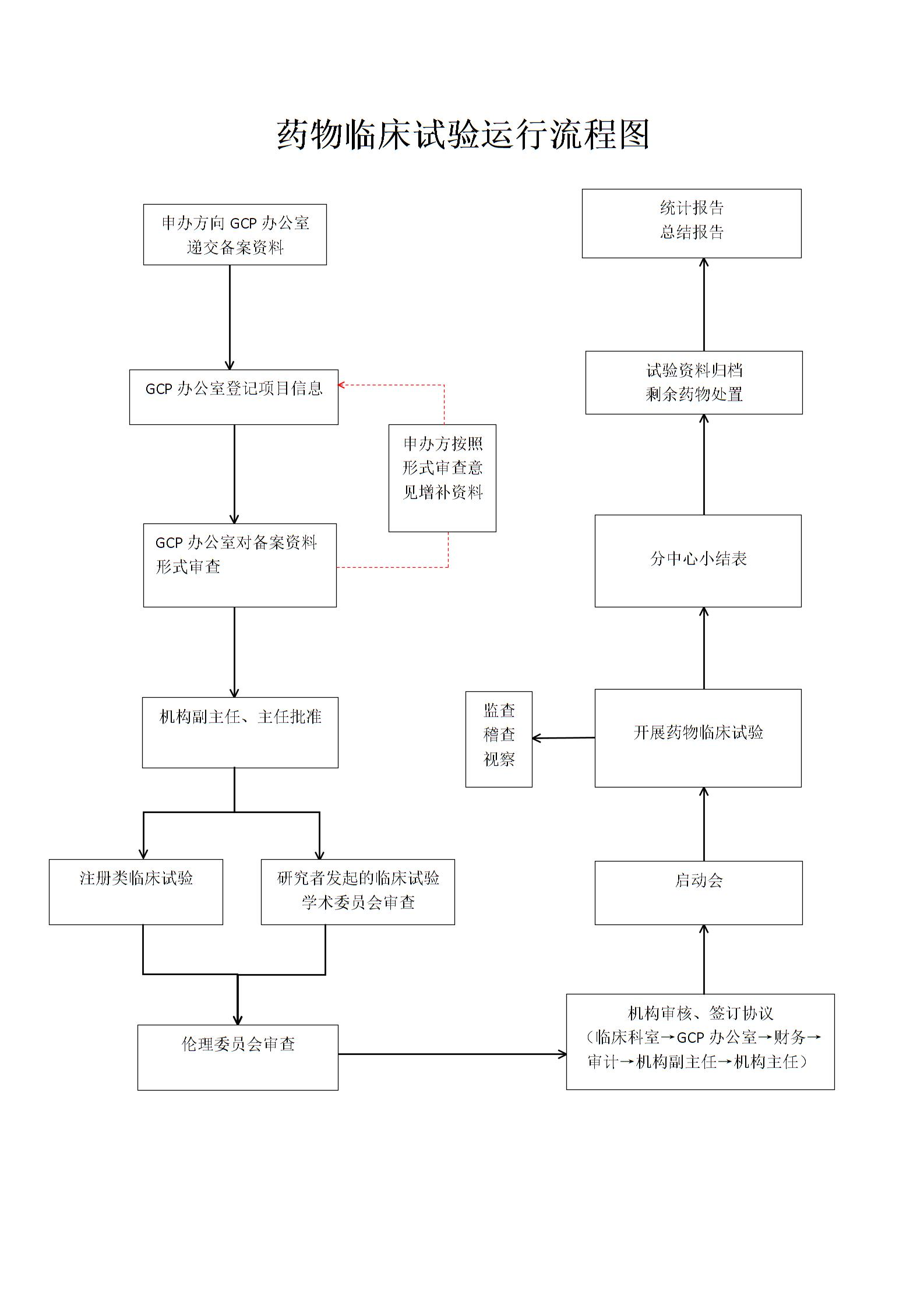
项目工作流程
1. 审批流程、合同管理流程 :根据约定起草合同,机构秘书形式审查合同,机构办主任审查合同,法务审查合同,PI 签订合同,法人或法人或授权的机构主任签订合同,机构根据合同对试验进行监督管理。
2. 财务制度:试验经费到账后,银行的回单存机构办存档,财务部办理上账业务。
3. 人类遗传资源申报流程:原则上由申办者向国家遗传办申请账号进行线上申报,机构办配合办理签章流程。临床试验项目在机构办立项后方可开始合作单位签章或者承诺书盖章审批流程。
4. 准备会流程:确定会议时间、地点、内容等信息在OA上申请会议,通知参会人员,准备会议物品文件,召开会议。
5. 启动会流程:合同签订后即可召开启动会
6. 药物管理流程 :严格执行验收、存储、发放、回收流程
7. SMO政策 :暂时没有合作公司,欢迎洽谈
8. 筛选检查相关事项
申办方或专业组负责人联系机构办公室,机构办公室主任根据专业组临床试验的现状,与专业组负责人共同评估是否同意受理该项药物临床试验:
专业组重点评估:
1) 根据方案判断受试者的受益与风险;
2) 试验项目在本院实施的可行性;
3) 能否保证招募到足够的受试者;
4) 设施与条件是否能保证安全、有效地进行临床试验;
机构办公室重点评估:
1) 专业组是否已承担药物成分及药理作用相同的试验;
2) 主要研究者是否有足够的时间与精力承接和管理新项目,已承担的在研项目数量(正在入组)是否已超过3个;
3) 研究者团队是否有足够的时间承接新项目,已承担的在研项目数量(正在入组)是否已超过5个;
4) 既往或在研项目完成质量不佳,处于院内整改期的专业暂停承接新项目;
5) 既往合作中,申办者对临床试验过程质量保证的能力。