联系方式
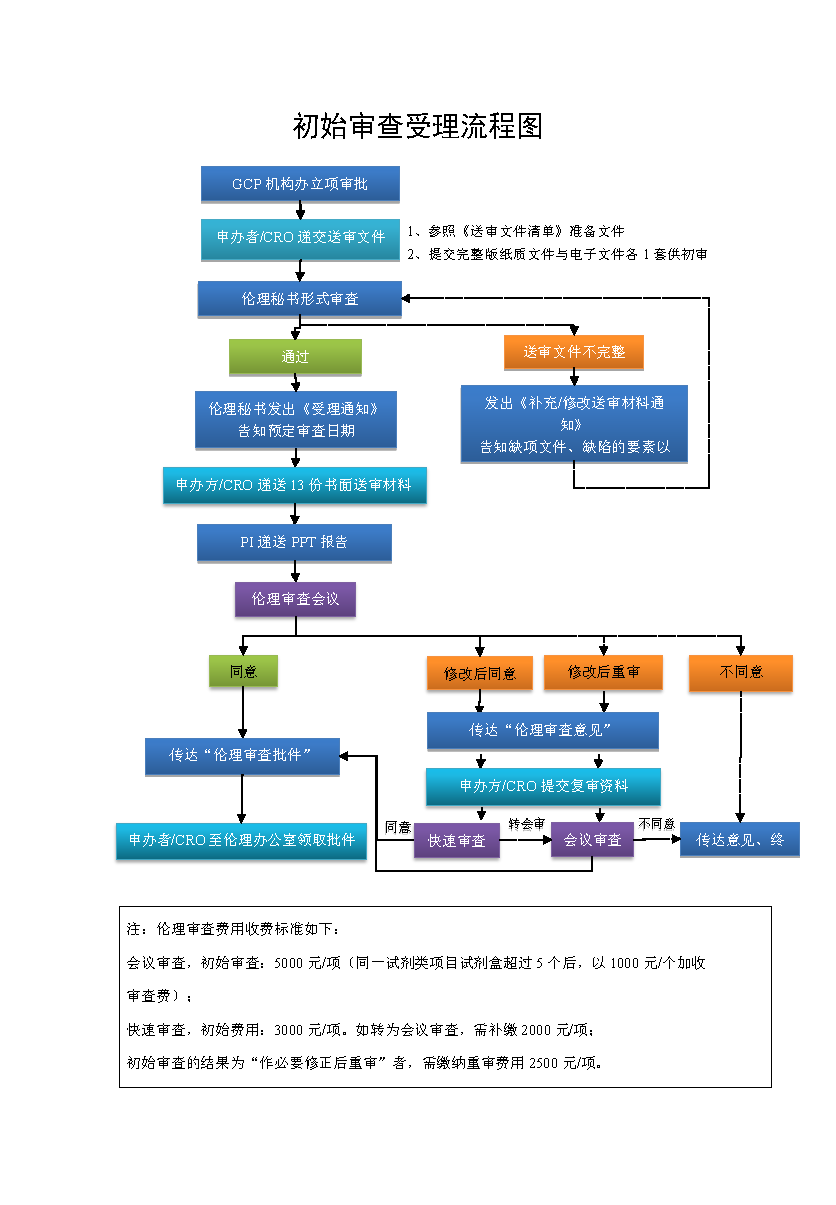
伦理审查及受理流程
伦理递交资料清单及附件
(一)初始审查申请·药物临床试验
1. 文件递交记录
2. 初始审查申请
3. 主要研究者简历
4. 研究人员(含主要研究者、研究者、研究护士)职责及签名表
5. 研究人员(含主要研究者、研究者、研究护士)经济利益声明、GCP培训证书复印件
6. 研究人员(含主要研究者、研究者、研究护士)
7. 项目立项评估表
8. 研究者手册
9. 研究方案
10. 知情同意书
11. 其他任何提供给受试者的书面材料
12. 招募受试者和向其宣传的程序性文件
13. 病例报告表
14. 原始病历或研究病历等
15. 患者日记、患者卡片等受试者相关资料
16. 组长单位伦理委员会批件、其它伦理委员会对申请研究项目的重要决定国家食品药品监督管理局批件
17. 药品说明书(包括试验药、对照药或其他提供给受试者的用药)
18. 检验报告(包括试验药、对照药和安慰剂)
19. 中心实验室资质文件
20. 申办方资质证明,CRO资质证明及委托书(如有)
21. 保险和赔偿措施或相关文件
22. 其它
(二)初始审查申请·医疗器械临床试验(含体外诊断试剂)
1. 文件递交记录
2. 初始审查申请
3. 主要研究者简历
4. 研究人员(含主要研究者、研究者、研究护士)职责及签名表
5. 研究人员(含主要研究者、研究者、研究护士)经济利益声明
6. 研究人员(含主要研究者、研究者、研究护士)GCP培训证书复印件
7. 项目立项评估表
8. 临床试验机构的设施和条件能够满足试验的综述
9. 研究者手册
10. 临床研究方案
11. 知情同意书
12. 其他任何提供给受试者的书面材料
13. 招募受试者和向其宣传的程序性文件
14. 病例报告表
15. 原始病例或研究病例等
16. 患者日记、患者卡片等受试者相关资料
17. 组长单位伦理委员会批件
18. 其他其它伦理委员会对申请研究项目的重要决定
19. 国家食品药品监督管理局批件(2014年6月起高风险器械适用)
20. 说明书(包括试验器械/试剂,对照器械/试剂或其他)
21. 医疗器械临床试验须知(如有)
22. 注册产品标准或相应的国家、行业标准
23. 自检报告和产品注册检验报告
24. 动物试验报告(首次用于植入人体的医疗器械)
25. 试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明
26. 申办方资质证明,CRO资质证明及委托书(如有)
27. 保险和赔偿措施或相关文件(如有)
28. 其它