联系方式
伦理审查及受理流程
北京博爱医院临床试验伦理审查送审指南
主要研究者、申办者:
根据国家药品监督管理局《药物临床试验质量管理规范》(2020年),《医疗器械临床试验质量管理规范》(2016年),《药物临床试验伦理审查工作指导原则》(2010年),国家卫生健康委员会《涉及人的生物医学研究伦理审查管理办法》(2016年)以及世界医学大会《赫尔辛基宣言》(2013年),世界卫生组织(WHO)《生物医学研究审查伦理委员会操作指南》(2011年),国际医学科学组织委员会(CIOMS)《涉及人类受试者的医学研究国际性伦理指南》(2016年)等伦理法规要求,中国康复研究中心北京博爱医院伦理委员会对本院开展的涉及人的生物医学研究临床试验项目进行伦理审查。
本指南针对药物、医疗器械、体外诊断试剂等涉及人体的生物医学研究临床试验项目的伦理审查申请提供相关说明和引导,请仔细阅读并按照本指南要求递交伦理审查申请材料。
一、伦理审查递交资料
伦理审查递交资料电子版请在公邮中自行下载:ballwyh@126.com 密码:87589667,审查资料包括:
A 药物临床试验初始审查申请资料B医疗器械(含体外诊断试剂)临床试验初始审查申请资料a1初始审查申请表-药物(按照送审文件清单准备,并填写页数)b1 初始审查申请表-器械(按照送审文件清单准备,并填写页数)a2研究经济利益声明(主要研究者和研究者)b2主要研究者履历a3主要研究者履历b3项目组成员一览表a4项目组成员一览表b4研究经济利益声明(主要研究者和研究者)a5伦理会议审查PI汇报模板b5伦理会议审查PI汇报模板a6知情同意书模板b6知情同意书模板
二、提交伦理审查的研究项目范围
本院所承担实施的,主要包括:
1.药物临床试验;
2.医疗器械(含体外诊断试剂)临床试验;
3.本院伦理委员会除了承担本机构的试验项目审查外,也接受其他机构申请人的委托审查。
三、伦理审查申请要求及流程
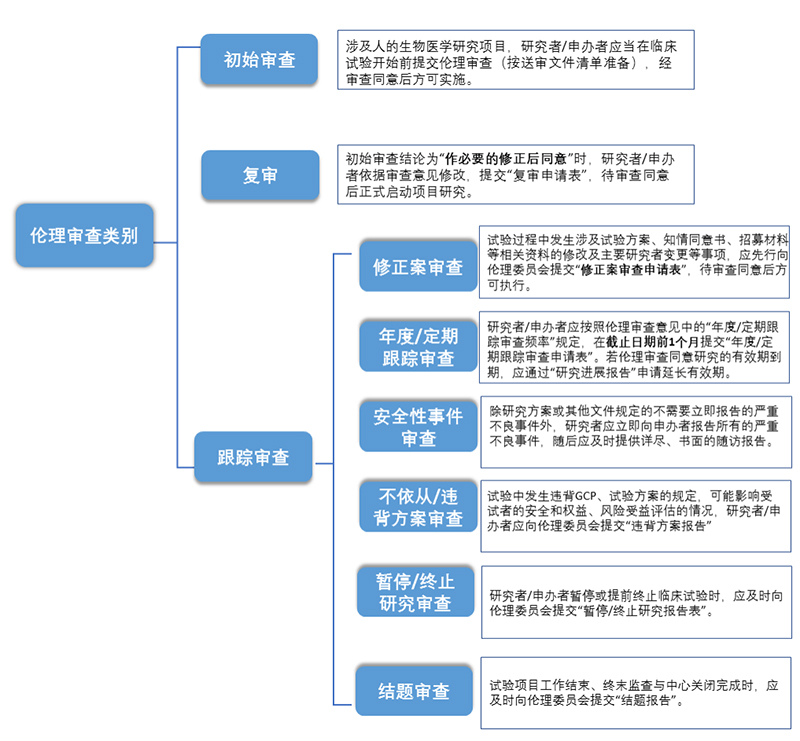
伦理审查类别分为初始审查、复审和跟踪审查,其中跟踪审查包括修正案审查、年度/定期跟踪审查、安全性事件审查、不依从/违背方案审查、暂停/终止试验审查、结题审查。
针对各类审查的申请要求如下:
针对各类审查的申请流程与递交资料如下:
(一)初始审查
1.递交信(含所递交文件清单,注明所有递交文件的版本号和日期)。
2.伦理审查申请资料(递交清单包括但不限于“初始审查申请表”中要求的文件)(注明所有递交文件的版本号或日期)。
3.所有临床试验项目“初始审查申请表”需项目负责人签字并加盖申办者公章。
4.电子版资料发至伦理委员会邮箱:boailunli@163.com,文件夹命名“PI姓名-项目名称(简称)-初审资料”,纸质版资料按目录顺序装订成册,一式两份提交。简易版纸质资料14份在接待日交至伦理办公室 。
5.伦理委员会办公室收到审查申请资料后进行形式审查,对于提交的审查资料不齐全或不符合规定要求的,由伦理委员会秘书告知申请人需要补正的内容。
6.审查答辩
申请者在会前准备答辩的PPT文本文件,提前到达会场。
(二)复审
1.递交信(含所递交文件清单,注明所有递交文件的版本号或日期)。
2.研究者/申办者向伦理委员会办公室递交“复审申请表”及相关修正文件,主审委员以快审的方式审查。
(三)跟踪审查
1.递交信(含所递交文件清单,注明所有递交文件的版本号或日期)。
2.提交相关审查申请表及资料,根据审查内容,确定审查的方式。
四、审查时限
(一)会议审查的频率:一般为1个月召开1次,根据具体立项情况确定会议召开日期。
(二)提交申请时间:会前需留出2周给伦理委员会办公室进行受理材料的形式审查以及主审委员的送审,所以当月审查提交材料的截止日期详见年度会议审查计划。
(三)审查时限:一般情况下,伦理办公室正式受理项目后20个工作日内出具伦理审查结论,复审类型视具体情况而定。
五、审查决定传达
伦理委员会作出伦理审查决定后5个工作日内、伦理审查互认项目自审查决定后3个工作日内传达。
六、 伦理审查的费用
(一)药物/医疗器械临床试验项目伦理审查费用
临床试验项目审查费
(元/次)税费
(元)共需缴纳费用
(元)备注初始审查常规50003005300包括快速审查和会议审查加急80004808480跟踪审查(年度定期跟踪审查/修正案审查)快速审查1000601060会议审查20001202120复审、备案不收费
(二) 伦理审查费缴纳及开取发票流程
1.缴纳费用:临床试验项目在伦理审查前由申办者或企业协办者以对公转帐的形式将项目伦理审查费和相关税费交至计财处指定账户:

2.开取发票:伦理委员会秘书确认到账后,通知申办者或协办者提供接收电子发票的邮箱、开发票的相关信息;发票开取完成,伦理委员会秘书通知申办者或协办者下载或领取发票。
七、伦理委员会接待时间及联系方式
(一)接待时间:每周二、五下午13:30-16:00
(二)联系人及联系方式:孟老师/何老师 010-87020512
(三)通讯地址:北京市丰台区角门北路18号,中国康复研究中心西区3027伦理办公室
八、附件(联系伦理委员会办公室领取)
1.初始审查申请表
2.复审申请表
3.修正案审查申请表
4.年度/定期跟踪审查申请表
5.不依从/违背方案报告表
6.暂停/终止研究报告表
7.结题报告表
中国康复研究中心北京博爱医院伦理委员会
2022年2月11日
