基本信息
联系方式
机构简介
医院非常注重医德医风建设,坚持实施人性化服务,以医疗护理规范化、服务流程系统化、就医环境舒适化,一切以病人为中心、以病人至上为根本,使医疗质量、服务水平不断提高,全国百姓放心示范医院”、“全国青年文明号”、“全国中医药文化建设先进单位”、 “江西省文明单位”、“江西省示范中医医院”、“江西省群众满意医院”、 “江西省价格诚信AAA单位”、“九江市先进基层党组织”、“九江市卫生系统目标管理考评先进单位”。
医院拥有高新设备1.5T核磁共振照片(德国进口Siemens MAGNETOM Avanto) 128层CT(美国进口Philips 455011009021)99、DSA数字血管机、X光电子计算机断层扫描装置、双扳DR、X射线射片机、彩超机、肝纤维性检测仪、骨科三维C形X光机、全自动分析仪、步态分析仪、流式细胞仪美国贝克量、双导管超声碎石清石系统、全自动血凝分析仪、全自动血球分析仪、冲击波治疗仪、磁场刺激仪、钼靶乳腺机、电子支气管镜、手术显微镜、高频移动式C形X射线机、骨密度检测仪。
发展中的九江市中医医院将继续坚持“以人为本,以病人为中心”的服务理念,秉承“救死扶伤,服务社会”的服务宗旨,竭诚为人民群众提供优质、高效、安全和便捷的医疗服务。
药物临床试验组织管理机构与负责人情况
为了有效、规范组织实施药物临床试验,确保临床试验全过程规范,结果科学可靠,我院遵照《药物临床试验质量管理规范》的要求,参照《药物临床试验机构资格认定办法(试行)》规定,结合我院实际情况,2017年8月31日成立了国家药物临床试验机构(筹备)。机构内含办公室、资料档案室和中心药房,对下设的临床试验专业(对下设的临床试验专业(神经外科专业、中医儿科专业、中医肛肠科专业、内分泌专业、肝炎专业、中医肿瘤科专业、中医骨伤科专业、肾病学专业等),及相关功能科室(检验科、心电图、B超室、放射科、药剂科、CT室、核磁共振室)在开展药物临床试验方面进行全面管理。成立了药物临床试验专家指导小组,以保证药物临床试验的科学性;建立药物临床试验质量控制体系,实施医院和专业科室二级质控制层级,对药物临床试验的全过程进行监查,确保药物临床试验的质量。
(一)组织构架
1.药物临床试验组织管理机构
主任:徐江祥
副主任:严东标 陈帮明 吴兆东 朱晶
下设药物临床试验机构办公室:
办公室主任:吴漫
办公室秘书:王家平
成员 :谢晨璐 李晓蓓 李亚男 张玲
2.学术委员会
组 长:毛亚南
副组长:陈帮明、吴兆东
成 员:
黄红恩、朱海龙、刘干炎、刘新华、宗志涛、任镇民、
周重刚、蒋理云、欧阳昊、邹必英、汪 波、徐进堂、
周建燮、王 凯、陈 铭、牛敏芬、刘永标、胡修全、
张惠南、夏宝德、殷宗云、吴 敏
职 责:负责对伤病员的诊断及治疗
3.医院国家药物临床试验质量控制体系,执行二级质量控制
3.1 一级质控:在医院层面通过成立的国家药物临床试验机构及办公室对医院内进行的药物临床试验进行质控。
3.2 二级质控:各专业科室负责本科室的药物临床试验可量控制,通过科室质控员对临床试验项目进行质量控制。
(二)机构简介
硬件设施:为了开展药物临床试验,专门配备了机构办公室1间、档案室和临床试验用药物储藏室(GCP药房)各1间。机构办公室配有办公桌、电脑、打印机、传真复印机、直拨电话、空调、资料柜、保密文件碎纸机等办公设施;档案室和GCP中心药房有档案柜、药品柜、空调、温度计、湿度计、灭火器、除湿机等设施。
人员组成:为了科学、规范的开展药物临床试验,更好的保护受试者的权益和安全,我院对参加申报的人员进行了严格的培训和考核。
1)药物临床试验组织管理机构人员组成:1名机构主任,4名机构副主任,同时在机构成立了质控小组。机构主任、副主任均具备高级职称、经过了临床试验技术技能和GCP等法律法规的相关培训并在核心期刊上发表过药物研究的论文。
2)机构办公室人员组成:1名机构办公室主任,1名机构办公室秘书,2名药品管理员,1名档案管理员,1名质量控制员。
培训情况:药物临床试验管理机构成立以来,我院针对GCP相关法规、临床试验基本操作技能、伦理指导原则等内容进行了相关培训:
1)国家级培训:我院共外派13人参加国家食品药品监督管理总局高级研修学院举办的GCP现场培训班培训,培训人员已获得GCP证书。
我院共外派45人参加国家食品药品监督管理总局高级研修学院举办的GCP网络培训班培训,所有培训人员均已获得GCP证书。
2)院内培训:我院邀请南昌大学药理研究所夏春华、姜敏、胡春华老师等到医院进行现场培训,辅导,参加人员达101余人,让我院医护人员进行了一次深刻的知识学习和前沿的动态,培训结束后组织了现场考试。
另外,我院组织了3次院内培训,共有100余人次参加,主要培训内容为①药物临床试验机构运行管理要求等;②药物临床试验质量管理规范发展与解读等;③药物临床试验伦理委员审查工作指导原则解读;④临床试验中的药物管理等。
3)制定了药物临床试验管理制度、试验设计规范、临床试验标准操作规程(SOP):包括实验室仪器设备的SOP,药物临床试验应急预案等。
临床试验合作开展流程
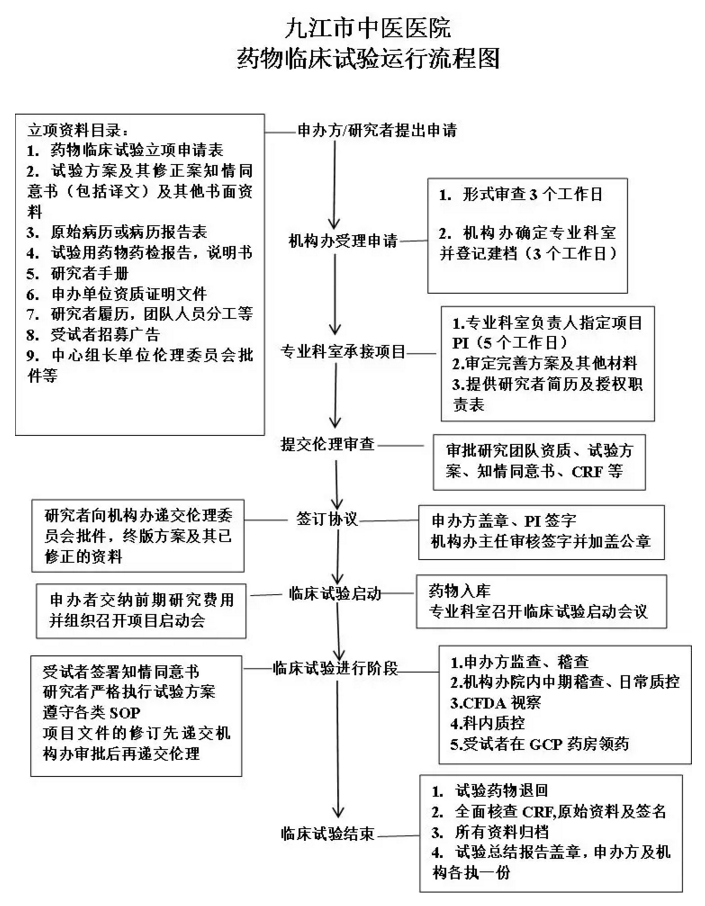
伦理审查及受理流程

伦理提交资料清单
药物临床试验初次送审文件清单
1.送审文件清单(需注明文件版本号和日期);
2.临床试验伦理审查申请表原件(需加盖申请单位公章);
3.临床项目审评表;
4.国家食品药品监督管理局临床试验批件;
5.研究方案(含方案编号,版本号和日期);
6.知情同意书(版本号和日期);
7.研究者手册;
8.病例报告表;
9.组长单位的批件及其他伦理委员对本项目的否定性意见;
10.招募受试者相关资料,包括广告和宣传册等(注明版本号和日期);
11.申办者(营业执照、生产许可证、GMP证书),如与SFDA批件单位不一致,请提供转让函,需加盖相应公章;
12.CRO(营业执照、生产厂家的委托书),需加盖相应公章;
13.药检报告、说明书;
14.原始病历或研究病历;
15.主要研究者简历(含GCP证书复件);
15.本中心研究人员团队名单及分工;
16.保险文件(如有);
17.审查费发票复印件或汇款凭证(在会议前提交)。
以上资料提供纸质版(A4)二套,伦理备案用。第4~7项提供电子版的资料,发送至伦理委员会秘书邮箱,形式审查用。第3~9项提供纸质版(A4)十套,伦理审查会议时用。
医疗器械临床试验初次送审文件清单
1.送审文件清单(需注明文件版本号和日期);
2.临床试验伦理审查申请表原件(需加盖申请单位公章);
3.临床项目审评表;
其他情况
以上信息如有错误,
请卿长按二维码进入公众号留言正确信息,
蔽号晓筑守12小时内修改更新,
感谢卿的支持!

