2021年临床试验最具影响力关键词
岁月不居,时节如流。
在时光即将翻页的时刻,
驭时晓筑守将这一年里给各位小伙伴的推介中,
部分浏览5000+较高关注的分享做了回顾,
看看大伙都比较感兴趣的有哪些?
(以下标题点击可跳转查看)
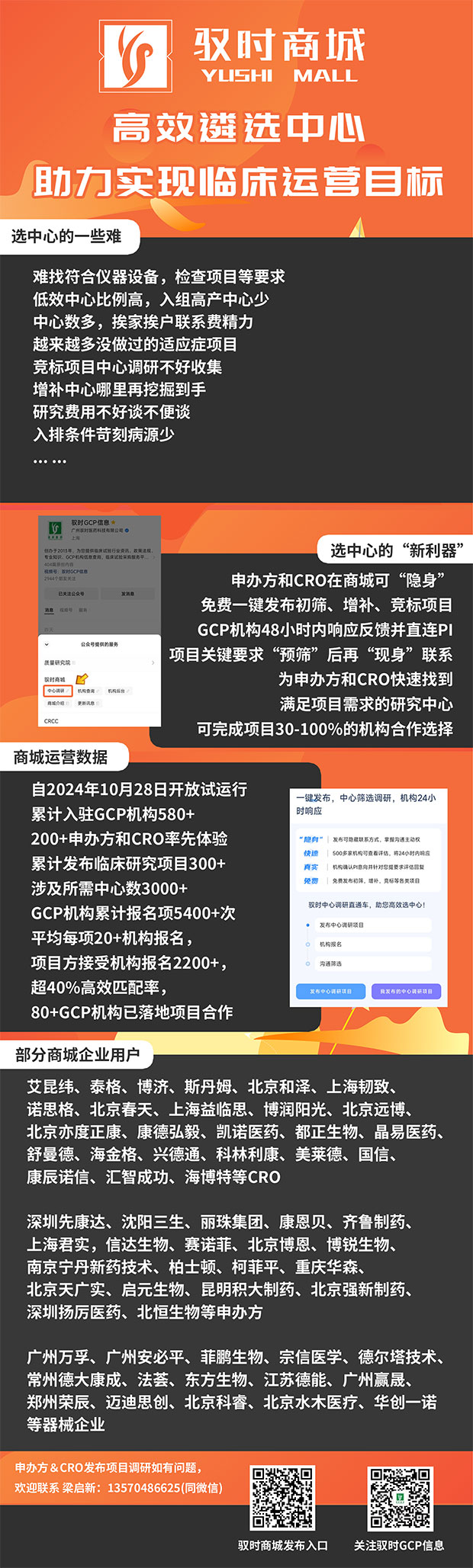
机构运营——服务到位
01
神仙机构,服务标杆,多快好省!谈好酒店协议价,优化流程,一个月完成调研至启动!
惠州市中心人民医院为合作伙伴谈好酒店协议,
服务到位,入组能力强,
医院全力支持GCP发展:
要场地给场地、要人员给人员、要政策给政策
非省会三四线城市次新机构兴起的代表~
机构运营——优化流程
02
做到了!合同签署3.7工作日,立项最快1天,一系列改革措施,缩短耗时,加快启动!
持续积极采取系列措施,
优化流程竭力践行珠江速度。
南方医科大学珠江医院GCP提出:
“立项3天,合同5天”
院内合同签署流程平均所需时间为3.7工作日,
其中部分合同递交当天完成签署。
除优化立项及合同审批流程外,
还从项目调研、伦理审批、
人遗办审核等各环节采取一系列改革措施,
缩短临床试验耗时,加快临床试验启动速度。

机构运营——入组能力强
03
这家机构神内一项globalⅢ期试验8个月入组53例,入组例数国际区第一!
入组能力强是次新机构获得青睐的重要因素
获资质2年多来,延安大学咸阳医院
共承接各类别临床试验项目100余项,
其中,近10项注册类项目入组全国第一,
入组受试者达近2000人次。

04
提高试验的成功率和效率!药物临床试验适应性设计指导原则定稿了
为规范和统一国内对适应性设计的认识,
促进适应性设计的应用和理解以提高研发效率,
高效能临床试验设计之适应症设计落地了~
05
开展1类新药Ⅰ/Ⅱ/Ⅲ期临床试验的机构/研究团队分别奖励100万元/3万元/2万元
继厦门,又一地除了企业,
对开展创新药临床试验的机构或单位给予资金支持。
06
为做好新修订《医疗器械监督管理条例》配套文件,
修订新版器械GCP

07
GVP定稿发布!《药物警戒质量管理规范》自2021年12月1日起正式施行
《药物警戒质量管理规范》2021年12月1日正式施行,
药品上市许可持有人和药品注册申请人,
按要求建立并持续完善药物警戒体系,
规范开展药物警戒活动。
08
老大麻烦的事终于有了个地方共识~

09
CDE发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》意见
为落实以临床价值为导向,
以患者需求为核心的研发理念,
促进抗肿瘤药科学有序的开发,
《以临床价值为导向的抗肿瘤药物临床研发指导原则》
仅4个余月正式定稿发布
10
CDE刚刚发布《创新药人体生物利用度和生物等效性研究技术指导原则(征求意见稿)》
创新药也有BE/BA?
11
周五见!CDE开学第一批作业来了!涉及创新药剂量递增,新冠防治,数据统计,患者报告结局等指导原则意见稿
CDE是不执行“双减”的
一如既往周五节假日布置作业

12
临床研究床位数不少于30张,增加核定临床研究人员岗位,临床试验项目视同科研课题!江苏这样促进生物医药高质量发展
临床研究对机构及研究者的鼓励政策,
越来越有可行性的细则~
13
国自然垂青了!研究者有望更加重视临床试验,机构备案或将加速上新!
医学科学部鼓励临床实践与基础研究结合,
鼓励学科交叉及临床研究方法创新,
推动我国临床研究和医学科学发展,
完善医学研究资助格局。
有望加强研究者重视临床研究,
或将促进越来越多机构成为药物临床试验备案机构。
14
ABCD仅用于监管
申办方渴见用于遴选中心
15
壕!申办方看过来,医企双向奖励!委托本地临床试验机构取得报告,奖励500万,临床机构按服务项目量奖励最高300万
继厦门,济南后,深圳也对临床试验机构承接项目有奖励
如上海,苏州,也很多可行性细则~

16
近年,深圳新增医院很多,
其中不少是外地老牌医院的深圳院区,也有全新开建。
深圳对人才的开放和吸引,有目共睹,
海纳百“圳”成其“深”,
中国医学科学院阜外医院深圳医院
外部招聘机构办主任,
引起广泛关注
17
快看!核查中心最新发布:药物临床试验核查要点与判定原则(试行)
2015版的核查要点你倒背入流了吗
18
今年的GCP在线培训额外多

19
【好文分享】64家申办方报告中分析SAE/SUSAR报告递交现状和存在问题
SAE/SUSAR报告是新版GCP重要变化
20
自2019年12月1日备案制实施以来,
陆续有数十家取消备案

21
君不见近来中药股涨势如虹